ಸಮಸ್ಥಾನಿ
ಸಮಸ್ಥಾನಿ (ಐಸೋಟೋಪು) ಎಂದರೆ ಒಂದು ಮೂಲಧಾತುವಿನ ಭಿನ್ನ ಪರಮಾಣು ತೂಕವನ್ನು ಹೊಂದಿರುವ ಒಂದು ಅಥವಾ ಹೆಚ್ಚಿನ ಪರಮಾಣುಗಳು. ಐಸೋಟೋಪುಗಳು ಒಂದೇ ಪರಮಾಣು ಸಂಖ್ಯೆ ಇರುವ (ಆದ್ದರಿಂದ ಒಂದೇ ಧಾತು ಆಗಿರುವ) ಆದರೆ ದ್ರವ್ಯಮಾನ ಸಂಖ್ಯೆಯಲ್ಲಿ (ರಾಶಿಸಂಖ್ಯೆ) ಭಿನ್ನವಾಗಿರುವ ಎರಡು ಅಥವಾ ಹೆಚ್ಚು ನ್ಯೂಕ್ಲೈಡುಗಳು.[೧] ಸಮಸ್ಥಾನಿಗಳ ಪರಮಾಣು ಕೇಂದ್ರ(nuclei)ದಲ್ಲಿ ಪ್ರೋಟಾನ್ನ ಸಂಖ್ಯೆ ಸಮನಾಗಿದ್ದರೂ ನ್ಯೂಟ್ರಾನ್ಗಳ ಸಂಖ್ಯೆ ಭಿನ್ನವಾಗಿರುತ್ತದೆ.
ಧಾತುಗಳ ಆವರ್ತಕೋಷ್ಟಕದಲ್ಲಿ ಇವು ಒಂದೇ ಸ್ಥಾನವನ್ನು ಪಡೆಯುತ್ತವೆ. ಪ್ರಪಂಚದ ಸಮಸ್ತ ವಸ್ತುಗಳಲ್ಲೂ ಸು. ೧೦೪ ಪ್ರತ್ಯೇಕ ಧಾತುಗಳ (ಎಂದರೆ ಪ್ರತ್ಯೇಕ ಪರಮಾಣುಗಳು) ಇವೆ; ಆದರೆ ಇಂಥ ನೈಸರ್ಗಿಕ ಮತ್ತು ಕೃತಕ ಧಾತುಗಳ ಸು. ೧೩೦೦ ಐಸೊಟೋಪುಗಳನ್ನು ಗುರುತಿಸಲಾಗಿದೆ.[೨]
ರಚನೆ
ಬದಲಾಯಿಸಿಪರಮಾಣು ಎಂದರೆ ತನ್ನ ನ್ಯೂಕ್ಲಿಯಸಿನಲ್ಲಿ ಪ್ರೋಟಾನ್ ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ ಕಣಗಳನ್ನು ಒತ್ತಟ್ಟಿಗೆ ದಟ್ಟವಾಗಿ ಕೂಡಿಸಿರುವ ಮತ್ತು ಹೊರಗಡೆ ಎಲೆಕ್ಟ್ರಾನುಗಳೆಂಬ ಅತಿಸೂಕ್ಷ್ಮ ಕಣಗಳನ್ನು ಪಡೆದಿರುವ ವ್ಯವಸ್ಥೆ. ನ್ಯೂಕ್ಲಿಯಸ್ ಸು. 10-13 ಸೆಂಮೀ ವ್ಯಾಸವುಳ್ಳುದಾದರೆ ಕೇಂದ್ರದಿಂದ ಸು. 10-8 ಸೆಂಮೀ ದೂರದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನುಗಳು ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಕಕ್ಷೆಗಳಲ್ಲಿ ನ್ಯೂಕ್ಲಿಯಸಿನ ಸುತ್ತಲೂ ವೇಗವಾಗಿ ಸುತ್ತುತ್ತವೆ. ಎಲೆಕ್ಟ್ರಾನಿನಲ್ಲಿ ಋಣವಿದ್ಯುತ್ −1.602176634×10−19 ಕೂಲಾಂಬಿನಷ್ಟಿದ್ದು[೩] ಇದರ ಭಾರ 9.1093837015(28)×10−31 ಕಿಗ್ರಾಂ[೪] ಇರುವುದು. ನ್ಯೂಟ್ರಾನಿನಲ್ಲಿ ವಿದ್ಯುದಂಶವಿಲ್ಲ. ಇದರ ಭಾರ 1.6748x10-27 ಕಿಗ್ರಾಂ.[೫] ಪ್ರೋಟಾನಿನಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನಿನಲ್ಲಿದ್ದಷ್ಟೆ ವಿದ್ಯುತ್ತು ಇದ್ದು ಇದರ ಭಾರ 1.6725x10-27 ಕಿಗ್ರಾಂ.[೬] ಪರಮಾಣುವೊಂದರ ಭಾರ ಪ್ರೋಟಾನ್ ನ್ಯೂಟ್ರಾನುಗಳಿಂದ ಏರ್ಪಡುತ್ತದೆ. ಕಾರಣ ಎಲೆಕ್ಟ್ರಾನುಗಳ ತೂಕ ಅತ್ಯಲ್ಪ.
ಐಸೋಟೋಪುಗಳ ಆವಿಷ್ಕಾರ
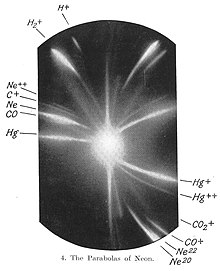
ಬದಲಾಯಿಸಿಜೆ.ಜೆ. ಥಾಮ್ಸನ್ 1913ರಲ್ಲಿ ನಡೆಸಿದ ಪ್ರಯೋಗವನ್ನು ಇಲ್ಲಿ ಮೊದಲು ಸ್ಮರಿಸಬೇಕು. ಹೈಡ್ರೊಜನ್ ಧಾತುವಿನ ಧನ ಅಯಾನುಗಳನ್ನು ಪ್ರಬಲವಾದ ಹಾಗೂ ಏಕಕಾಲದಲ್ಲೂ ಏಕಸ್ಥಳದಲ್ಲೂ ವರ್ತಿಸುವ ಸ್ಥಾಯಿ ವಿದ್ಯುತ್ಕ್ಷೇತ್ರ ಮತ್ತು ಕಾಂತಕ್ಷೇತ್ರಗಳ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಎಲ್ಲ ಅಯಾನುಗಳಲ್ಲೂ ವಿದ್ಯುದಂಶ ಸಮಾನವಿದ್ದ ನಿಮಿತ್ತ ಇವುಗಳ ಭಾರಗಳಲ್ಲಿ ವ್ಯತ್ಯಾಸವಿದ್ದರೆ ಮಾತ್ರ ಇವು ಪ್ರತ್ಯೇಕ ಪಥಗಳಲ್ಲಿ ಮುಂಬರಿದು ಇವನ್ನು ಪರೀಕ್ಷಿಸುವ ಪರದೆಯ ಮೇಲೆ ಪ್ರತ್ಯೇಕ ಪ್ಯಾರಾಬೊಲಗಳನ್ನು ಗುರುತಿಸುತ್ತವೆ ಎಂದು ಊಹಿಸಿದ್ದ. ಈ ಊಹೆ ಪ್ರಯೋಗದಲ್ಲಿ ಸ್ಥಿರಪಟ್ಟಿತು-ಹೈಡ್ರೊಜನ್ ಧಾತುವನ್ನು ವಿರಳವಾಗಿ ತುಂಬಿಸಿದ ನಳಿಗೆಯೊಳಗಿನ ಪ್ರಯೋಗಗಳಲ್ಲಿ ಧಾತುವಿನ ಪರಮಾಣು ಮತ್ತು ಅಣುಗಳಿಗೆ ಅನುಗುಣವಾದ ಎರಡು ಪ್ಯಾರಾಬೊಲಗಳು ಕಂಡುಬಂದುವು. ಮುಂದೆ ನಿಯಾನ್ ಅನಿಲವನ್ನು ನಳಿಗೆಯೊಳಗೆ ಉಪಯೋಗಿಸಿದಾಗಲೂ ಇದೇ ಪರಿಸ್ಥಿತಿ ಉಂಟಾಯಿತು. ಗುಣಿಸಿ ನೋಡಿದಾಗ ಇಲ್ಲಿ e ಸಮಾನವಿರುತ್ತ ಪರಮಾಣು ಭಾರಗಳು 20 ಮತ್ತು 22 ರಂತಿರಬೇಕು ಎಂದು ನಿಶ್ಚಯಿಸಲಾಯಿತು. ಇದೇ ಐಸೊಟೋಪುಗಳ ಆವಿಷ್ಕಾರದ ಮೊತ್ತಮೊದಲಿನ ಯಶಸ್ವೀ ಪ್ರಯೋಗ.[೭][೮]
ಒಂದು ಪರಮಾಣುವಿನ ಐಸೊಟೋಪುಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸುವ ಇತರ ಪರಿಷ್ಕೃತ ಪ್ರಯೋಗಗಳನ್ನು ನಡೆಸಿದವರು ಎಫ್. ಡಬ್ಲ್ಯು. ಆಸ್ಟನ್, ಡೆಂಪ್ಸ್ಟರ್, ಬೈನ್ಬ್ರಿಡ್ಜ್ ಹಾಗೂ ನೀರ್. ಇವುಗಳಲ್ಲಿ ಆಯಾ ಧಾತುಗಳ ಅಯಾನುಗಳ ಚೂಪಾದ ಕಂಬಿಯೊಂದನ್ನು ಮೊದಲು ಪ್ರಬಲ ವಿದ್ಯುತ್ ಕ್ಷೇತ್ರದ ಮೂಲಕ ಹಾಯಿಸಿ ಅಲ್ಲಿ ಇವುಗಳ ವೇಗಕ್ಕೇ ಅನುಗುಣವಾಗಿ ವಿಸ್ತರಿಸಲಾಗುತ್ತದೆ; ಮುಂದೆ ಇವು ಕಾಂತಕ್ಷೇತ್ರವನ್ನು ದಾಟುವಷ್ಟರಲ್ಲಿ ಆಸ್ಟನ್ನಿನ ದ್ರವ್ಯಮಾನ ರೋಹಿತಲೇಖಕದಲ್ಲಿ (ಮಾಸ್ ಸ್ಟೆಕ್ಟ್ರೋಗ್ರಾಫ್) ಒಂದೇ ಭಾರದ ಕಣಗಳು (ಇವುಗಳ ವೇಗಗಳಲ್ಲಿ ಹೆಚ್ಚು ಕಡಿಮೆ ಇದ್ದರೂ) ಒಂದೆಡೆ ಬಂದು ನಿಶ್ಚಿತ ಸ್ಥಳದಲ್ಲಿ ಇಡಲಾದ ಫೋಟೋ ಫಲಕದ ಮೇಲೆ ಎರಗುವುವು. ಪ್ರತ್ಯೇಕ ಭಾರದ ಕಣಗಳು ಇನ್ನೊಂದೆಡೆ, ಮತ್ತೊಂದು ಭಾರದ ಕಣಗಳು ಮತ್ತೊಂದೆಡೆ ಎಂಬಂತೆ ಬಂದೆರಗುವ ಕಾರಣ ಮೂಲ ಕಂಬಿಯಲ್ಲಿನ ಕಣಗಳು ತಂತಮ್ಮ ದ್ರವ್ಯಮಾನಕ್ಕೆ ಅನುಗುಣವಾಗಿ ಚದರಿಹೋಗುವುವು (ಸ್ಕ್ಯಾಟರ್) ಮತ್ತು ಪ್ರತ್ಯೇಕಗೊಳ್ಳುವುವು. ಇವುಗಳ ಭಾರಗಳನ್ನು ನಿರ್ಣಯಿಸಬಹುದು.[೯][೧೦]
ಸ್ಥಿರ ಮತ್ತು ಅಸ್ಥಿರ ಐಸೋಟೋಪುಗಳು
ಬದಲಾಯಿಸಿಹೆಚ್ಚೆಂದರೆ 104 ಪ್ರತ್ಯೇಕ ಧಾತುಗಳಿವೆ. ಇವುಗಳ ಪೈಕಿ ಪರಮಾಣು ಸಂಖ್ಯೆ 83ರ ಅನಂತರದ ಧಾತುಗಳು ವಿಕಿರಣಶೀಲವಾಗಿರುವುದರಿಂದ ಅಸ್ಥಿರಗಳು. ಇವು ಅನವರತವೂ ಕಣಗಳನ್ನೊ ವಿಕಿರಣಗಳನ್ನೊ (ರೇಡಿಯೇಷನ್) ಕಕ್ಕುತ್ತ ಕೊನೆಗೆ 83 ಇಲ್ಲವೇ 82 ಪರಮಾಣು ಸಂಖ್ಯೆಯ ಧಾತುಗಳ ಐಸೊಟೋಪುಗಳಾಗಿ ಪರಿವರ್ತನೆ ಹೊಂದುತ್ತವೆ ಎಂದ ಬಳಿಕ 104 ಧಾತುಗಳ ಸುಮಾರು 1,300 ಐಸೊಟೋಪುಗಳಲ್ಲಿ ಇಂಥ ಅಸ್ಥಿರ ಐಸೊಟೋಪುಗಳು ಇದ್ದೇ ಇರಬೇಕೆಂಬ ಭಾವನೆ ಮೊದಲಲ್ಲೇ ಬೆಳೆಯಲಾರಂಭಿಸಿತು. ಹೀಗೆಯೇ ಪ್ರಯೋಗಗಳನ್ನು ನಡೆಸಿದಲ್ಲಿ ಹೈಡ್ರೊಜನ್ನಿನಿಂದ ಬಿಸ್ಮತ್ ತನಕ (1H ನಿಂದ 83Bi ತನಕ) 270ಕ್ಕೂ ಮಿಕ್ಕಿದ ಸ್ಥಿರ ಐಸೊಟೋಪುಗಳು ದೊರೆತವು. ಇವೇ ಅಲ್ಲದೆ ಇಂಥ ಸ್ವಯಂವಿಕಿರಣಕ್ರಿಯಾಶೀಲವಲ್ಲದ (ನಾನ್ರೇಡಿಯೊಆಕ್ಟಿವ್) ಧಾತುಗಳ ಕೆಲವು ಐಸೊಟೋಪುಗಳು ಸಹ ವಿಕಿರಣಕ್ರಿಯೆಯನ್ನು ತೋರುತ್ತವೆ.
ಉದಾಹರಣೆಗಳು
ಬದಲಾಯಿಸಿಒಂದು ಧಾತುವನ್ನು ಸಂಕೇತದಿಂದ ಬರೆಯುತ್ತೇವೆ. ಇಲ್ಲಿ Z ಇದರಲ್ಲಿನ ಪ್ರೋಟಾನುಗಳ ಸಂಖ್ಯೆ. ಇಷ್ಟೇ ಎಲೆಕ್ಟ್ರಾನುಗಳು ಕೇಂದ್ರೇತರ ಭಾಗದಲ್ಲಿವೆ. ಈ ಸಂಖ್ಯೆಯೇ ಆವರ್ತಕೋಷ್ಟಕದಲ್ಲಿ ಈ ಧಾತುವಿನ ಸ್ಥಾನವನ್ನು ಸೂಚಿಸುತ್ತದೆ. ಇದರ ಹೆಸರು ಧಾತುವಿನ ಪರಮಾಣು ಸಂಖ್ಯೆ. ನ್ಯೂಕ್ಲಿಯಸಿನಲ್ಲಿ N ನ್ಯೂಟ್ರಾನುಗಳಿದ್ದರೆ ಆಗ Z+N ಪರಮಾಣುವಿನ ಭಾರ A ಯನ್ನು ಸೂಚಿಸುತ್ತದೆ. ಎಂಬುದರ ಭಾರ 4, ಸಂಖ್ಯೆ 2, ಪ್ರೋಟಾನುಗಳ ಸಂಖ್ಯೆ 2, ನ್ಯೂಟ್ರಾನುಗಳ ಸಂಖ್ಯೆ 2.[೧೧]
ಉದಾಹರಣೆಗೆ ಜಲಜನಕ ಮೂರು ಸಮಸ್ಥಾನಿಗಳನ್ನು ಹೊಂದಿದೆ. ಇದರ ಅತ್ಯಂತ ಹೇರಳವಾಗಿರುವ ಸಮಸ್ಥಾನಿ ಪ್ರೋಟಿಯಮ್ನ ಪರಮಾಣು ತೂಕ ಒಂದು. ಎಂದರೆ ಇದರ ಕೇಂದ್ರದಲ್ಲಿ ಒಂದು ಪ್ರೋಟಾನ್ ಮಾತ್ರವಿದ್ದು ನ್ಯೂಟ್ರಾನ್ ಇರುವುದಿಲ್ಲ. ಎರಡನೇ ಸಮಸ್ಥಾನಿ ಡಿಟಿರಿಯಮ್ (deuterium)ನ ಕೇಂದ್ರದಲ್ಲಿ ಒಂದು ಪ್ರೊಟಾನ್ ಹಾಗೂ ಒಂದು ನ್ಯೂಟ್ರಾನ್ ಇದ್ದು ಇದರ ಪರಮಾಣು ತೂಕ ೨ ಆಗಿದೆ. ಅಂತೆಯೇ ಮೂರನೆಯ ಹಾಗೂ ಭಾರವಾದ ಸಮಸ್ಥಾನಿ ಟ್ರೈಟಿಯಮ್ (Tritium) ನ ಕೇಂದ್ರದಲ್ಲಿ ಒಂದು ಪ್ರೊಟಾನ್ ಹಾಗೂ ಎರಡು ನ್ಯೂಟ್ರಾನ್ಗಳಿದ್ದು ಇದರ ಪರಮಾಣು ತೂಕ ೩ ಆಗಿರುತ್ತದೆ. ನ್ಯೂಟ್ರಾನ್ಗಳ ಸಂಖ್ಯೆಯಲ್ಲಿ ವ್ಯತ್ಯಾಸವಿದ್ದರೆ ಅದು ಪರಮಾಣುಗಳ ಗುಣಲಕ್ಷಣಗಳನ್ನು ಕೂಡ ಭಿನ್ನವಾಗಿ ನಿರೂಪಿಸುತ್ತದೆ.[೧೨] ಐಸೋಟೋಪ್ಗಳನ್ನು ಸೂಚಿಸುವಾಗ ಧಾತುವಿನ ಹೆಸರಿನ ಮುಂದೆ -ಬರೆದು ನಂತರ ಅದರ ಪರಮಾಣು ರಾಶಿ ಸಂಖ್ಯೆಯನ್ನು ಬರೆಯಲಾಗುತ್ತದೆ. ಉದಾ: ಇಂಗಾಲದ ಐಸೋಟೋಪ್ಗಳು ಇಂಗಾಲ-12, ಇಂಗಾಲ-13, ಇಂಗಾಲ-14 (Carbon-12, Carbon-13, Carbon-14)
ಯುರೇನಿಯಮ್
ಬದಲಾಯಿಸಿಯುರೇನಿಯಮ್ ಎಂಬುದರ ಭಾರ 238: ಪ್ರೋಟಾನುಗಳ ಸಂಖ್ಯೆ 92, ನ್ಯೂಟ್ರಾನುಗಳ ಸಂಖ್ಯೆ 146. ಇದನ್ನು ಹೀಗೆ ಬರೆಯುತ್ತಾರೆ: ಐಸೊಟೋಪುಗಳಿರಬಹುದೆಂಬ ಅನುಮಾನದ ಹಿನ್ನೆಲೆ: ಪ್ರೋಟಾನ್ ಹೈಡ್ರೋಜನ್ನಿನ ನ್ಯೂಕ್ಲಿಯಸ್ ಎಂದ ಬಳಿಕ ನ್ಯೂಟ್ರಾನ್ ಕೂಡ ಭಾರದಲ್ಲಿ ಸುಮಾರು ಪ್ರೋಟಾನಿನಷ್ಟೇ ಇರುವ ಕಾರಣ ಎಲ್ಲ ಧಾತುಗಳ ಪರಮಾಣುಭಾರಗಳೂ ಪೂರ್ಣಾಂಕಗಳೇ ಆಗಬೇಕು ಎಂಬ ಪ್ರೌಟ್ನ ಭಾವನೆ ಕಳೆದ ಶತಮಾನಗಳಲ್ಲಿ ನಡೆಸಿದ ಪರಮಾಣುಭಾರ ನಿರ್ಣಯದ ಪ್ರಯೋಗಗಳಿಂದ ಸಿದ್ಧವಾಗಲಿಲ್ಲ.[೧೩]: 682–683
ಸೀಸದ ರೂಪ
ಬದಲಾಯಿಸಿಕ್ಲೋರಿನ್ ಪರಮಾಣು ಭಾರ 35.453, ತಾಮ್ರದ ಪರಮಾಣುಭಾರ 63.54, ಸತುವಿನ ಪರಮಾಣು ಭಾರ 65.38. ಇವೇಕೆ ಹೀಗೆ ಭಿನ್ನಾಂಶಗಳನ್ನೊಳಗೊಂಡಿವೆ ಎಂಬುದು ಕುತೂಹಲದಾಯಕ ಪ್ರಶ್ನೆಯಾಗಿತ್ತು. ಇಷ್ಟರಲ್ಲೇ ಯುರೇನಿಯಮ್, ಆಕ್ಟೀನಿಯಮ್ ಮತ್ತು ಥೋರಿಯಮ್ ಧಾತುಗಳು ನೈಸರ್ಗಿಕವಾಗಿ ವಿಕಿರಣ ಕ್ರಿಯಾಶಕ್ತಿಯನ್ನು (ರೇಡಿಯೋ ಆಕ್ಟಿವಿಟಿ ) ಪ್ರದರ್ಶಿಸುತ್ತ ತಮ್ಮ ತಮ್ಮ ಶ್ರೇಣಿಗಳ ಅಂತ್ಯದಲ್ಲಿ ರೇಡಿಯಮ್ Ra, ಆಕ್ಟೀನಿಯಮ್ Ac ಮತ್ತು ಥೋರಿಯಮ್ Th ಆಗಿ ಪರಿವರ್ತನೆ ಹೊಂದುತ್ತಿರುವುದು ತಿಳಿದುಬಂದಿತು. ಇವೆಲ್ಲ ಪರಮಾಣು ಸಂಖ್ಯೆ 82 ಉಳ್ಳವು. ಇವನ್ನು ಪರಮಾಣುಸಂಖ್ಯೆ 82 ಇರುವ ಸೀಸದಿಂದ (Pb) ರಾಸಾಯನಿಕವಾಗಿ ಬೇರ್ಪಡಿಸಲಾರೆವು. ಚುಟುಕಿನಲ್ಲಿ ಇವು ಸೀಸದ ರೂಪಗಳೇ. ಇವನ್ನು ಮತ್ತು ಎಂದು ಬರೆದುಕೊಳ್ಳಬಹುದು. ಪ್ರೋಟಾನುಗಳ ಸಂಖ್ಯೆ ನ್ಯೂಕ್ಲಿಯಸಿನಲ್ಲಿ 82 ಮತ್ತು ಕೇಂದ್ರೇತರ ಭಾಗದಲ್ಲಿ 82 ಎಲೆಕ್ಟ್ರಾನುಗಳು ಇವೆಲ್ಲವುಗಳಲ್ಲಿಯೂ ಇವೆ; ಇವು ಸೀಸದ ಐಸೊಟೋಪುಗಳೇ ಎಂದು ಮೊತ್ತಮೊದಲು ಫ್ರೆಡರಿಕ್ ಸಾಡ್ಡಿ ಪ್ರತಿಪಾದಿಸಿದ. ಇವು ಐಸೊಟೋಪುಗಳೆಂದು ಅವನು ನಾಮಕರಣ ಮಾಡಿದನಲ್ಲದೆ[೧೪] ವಿವಿಧ ಐಸೊಟೋಪುಗಳ ಮಿಶ್ರಣವಿದ್ದುದರಿಂದಲೇ ಸಾಮಾನ್ಯ ಸೀಸದ ಪರಮಾಣು ಭಾರ 207.21 ಎಂದೂ ಸಾರಿದ. ಆದ್ದರಿಂದ Z ಒಂದೇ ಇರುವ ಆದರೆ N ನ ಬೆಲೆ ಹೆಚ್ಚು ಕಡಿಮೆಯಾಗುವ ಕಾರಣ ಭಾರ A(=Z+N) ವ್ಯತ್ಯಾಸವಾಗುವ ಧಾತುವಿನ ರೂಪಗಳೇ ಅದರ ಐಸೊಟೋಪುಗಳು. ಕೆಲವೇ ನಿದರ್ಶನಗಳನ್ನು ಪರಿಶೀಲಿಸಬಹುದು.
ಉಲ್ಲೇಖಗಳು
ಬದಲಾಯಿಸಿ- ↑ http://www.isotope.info/
- ↑ http://www.nucleonica.com/
- ↑ "2018 CODATA Value: elementary charge". The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ↑ "2018 CODATA Value: electron mass". The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ↑ "2018 CODATA recommended values" https://physics.nist.gov/cuu/Constants/index.html Archived 2018-01-22 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ.
- ↑ "2018 CODATA Value: proton mass". The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ↑ Thomson, J. J. (1912). "XIX. Further experiments on positive rays". Philosophical Magazine. Series 6. 24 (140): 209–253. doi:10.1080/14786440808637325.
- ↑ Thomson, J. J. (1910). "LXXXIII. Rays of positive electricity". Philosophical Magazine. Series 6. 20 (118): 752–767. doi:10.1080/14786441008636962.
- ↑ Aston, F. W. (1920). "Isotopes and Atomic Weights". Nature. 105 (2646): 617–619. doi:10.1038/105617a0. S2CID 4267919.
- ↑ Mass spectra and isotopes Francis W. Aston, Nobel prize lecture 1922
- ↑ This notation seems to have been introduced in the second half of the 1930s. Before that, various notations were used, such as Ne(22) for neon-22 (1934), Ne22 for neon-22 (1935), or even Pb210 for lead-210 (1933).
- ↑ Herzog, Gregory F. (2 June 2020). "Isotope". Encyclopedia Britannica.
- ↑ John L. Heilbron (14 February 2003). The Oxford Companion to the History of Modern Science. Oxford University Press. pp. 683–. ISBN 978-0-19-974376-6.
- ↑ "isotope—Origin and meaning". www.etymonline.com (in ಇಂಗ್ಲಿಷ್). Retrieved 21 October 2021.
ಬಾಹ್ಯಸಂಪರ್ಕಗಳು
ಬದಲಾಯಿಸಿ- Nucleonica Nuclear Science Portal
- Nucleonica Nuclear Science Wiki Archived 2009-06-13 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ.
- International Atomic Energy Agency
- Atomic weights of all isotopes
- Atomgewichte, Zerfallsenergien und Halbwertszeiten aller Isotope
- Chart of the Nuclides Archived 2008-07-03 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. produced by the Knolls Atomic Power Laboratory $25
- Exploring the Table of the Isotopes Archived 2006-12-05 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. at the LBNL
- Current isotope research and information
- Radioactive Isotopes by the CDC